体外受精・胚移植(in vitro fertilization & embryo transfer : IVF-ET)は現在の不妊治療に必要不可欠なものである。1978年、英国で初のIVF-ETによる児が誕生して以来、世界中で数多くの児が出生しており、日本でもIVF-ETにより平成10年12月31日現在、合計47591人の子供が誕生したと報告されている。最近では1年間に1万余人の児が出生している。しかし、その妊娠率は未だに決して高いものではない。平成10年度の全国平均によると、移植あたり臨床妊娠率は22.6%にすぎず、この数字は私達の東海大学病院においてもほぼ同じであった(過去11年間の全症例23.2%)。この最大の理由は、着床についてほとんど明らかになっていないためと考えられる。胚移植をした後は子宮というブラックボックスの中で何が起きているのかよくわかっていない現状では、ARTの手法は不完全であると言わざるを得ず、着床現象の早期解明が望まれる。
流産は臨床妊娠(clinical pregnancy)以降、すなわち胎嚢確認後の生殖ロスを指し、着床期からhCG陽性までの生殖ロスは不妊症と扱われる。さらに、hCG陽性から胎嚢確認前の生殖ロスを化学的流産(chemical abortion)というが、これを不育症と不妊症のどちらに取り扱うかは意見が分かれるところである。妊娠3週(着床期)、4週(hCG陽性)、5週(胎嚢確認)のいずれに境界線を引くべきであろうか。形態的診断である超音波検査は確かに精度が向上しているが、細胞レベルでは胎嚢確認のかなり前に母児間の交流があるので、不育症と不妊症(特にIVF-ET不成功例)の間には明確な境界線を引くことは本来難しいはずである。実際、IVF-ETの臨床では化学的流産というケースが非常に多いというのは、誰しも経験しているところであろう。「妊娠とは受精卵の着床に始まり、胎芽もしくは胎児および付属物の排出をもって終わる」ことであるから、「胎嚢の確認をもって臨床妊娠とする」考えはもはや古いのかもしれない。
本稿ではあえて不妊症と不育症の間に境界線をひくことなく、着床期から妊娠初期までの免疫異常について最近の知見を紹介する。
1.不妊、不育症における免疫・血液凝固学の位置付け
以前よりSLEをはじめとする自己免疫疾患の患者にpregnancy lossが多いことが知られ、母体の免疫能の異常が妊娠維持に障害を起こす可能性が指摘されてきた。最近になって、それが抗リン脂質抗体という自己抗体によって引き起こされるという説が注目されるようになり、抗リン脂質抗体と関連する不育症、反復血栓症、血小板減少症をまとめて抗リン脂質抗体症候群と称し、広く認知されるようになった。不育症と並んで血栓症や血小板減少症などの血栓・止血関係の疾患がその症候群の診断基準案に列挙されたということは、不育症の病因として免疫だけでなく、免疫・血液学的機序が存在する可能性が示唆されたことになる。また一方で、以前より血栓傾向のある患者に、胎盤血栓によると思われるpregnancy lossが多いことも指摘されており、近年、血栓性素因(thrombophilia)と不育症の関係も解明されつつある。thrombophiliaには主に先天的血栓傾向を示す疾患と、後天的な抗リン脂質抗体がある。先天的thrombophiliaの中には、アンチトロンビン、プロテインC、プロテインSなどの抗凝固因子の先天性欠乏症や、活性化プロテインCに対して抵抗性を示す第5因子Leiden mutationなどがある。
近年、フランスのグループ(The Nimes Obstetricians and Haematologists : NOHA)が不育症と血液凝固の関連について大規模な調査を行い、興味深い結果を発表している(NOHA study)。これによると、妊娠初期流産を繰り返しているタイプの不育症と、妊娠後期のfetal lossを起こすタイプの不育症では、その血液凝固異常の傾向が異なる。
妊娠初期流産を繰り返すタイプの不育症では線溶系の低下が多く見られ(約40%)、その内容は主にplasminogen activator inhibitor 1(PAI)活性亢進であった。具体的には、第12因子欠乏症(9.4%)と抗リン脂質抗体(7.4%)が2大原因として報告されており、我々の不育症外来でも同様の結果が得られている。第12因子はカリクレイン-キニン系の一員であり(図1)、線溶系に重要な役割を果たしている。したがって、第12因子の欠乏は線溶系の低下を引き起こし、血栓症、流産の原因となり得る。また、抗リン脂質抗体に関する我々のデータによると、妊娠初期流産を繰り返すタイプの不育症群ではキニノーゲンを認識する抗フォスファチジルエタノールアミン抗体(抗PE抗体)が多く見出された。キニノーゲンもまた第12因子と同様カリクレイン-キニン系の蛋白であり、それに対する自己抗体が存在すると線溶系を低下させる可能性がある。以上をまとめると、妊娠初期流産を繰り返すタイプの不育症の血液凝固学的特徴は線溶系の低下とまとめることができる。
これに対して妊娠後期のfetal lossを起こすタイプの不育症では、抗リン脂質抗体、プロテインS欠乏症、第5因子Leiden mutationがリスクファクターとして挙げられた。抗リン脂質抗体の病原性は未だ不明の点が多いが、抗カルジオリピン抗体はプロテインS,プロテインC経路を阻害するという説もあり、妊娠後期のfetal lossを起こすタイプの不育症の血液凝固学的特徴は、トロンボモジュリン/プロテインC/プロテインS/第5因子系の破綻とまとめることができるかもしれない。ただし、日本では今のところ第5因子Leiden mutationの報告はない。
また、単独では不育症のリスクファクターとなり得なかったが、methylenetetrahydrofolatereductase(MTHFR) gene のC677T mutationと上記リスクファクターとの強い相関関係が観察された。MTHFR geneのC677T mutationは高ホモシステイン血症を引き起こし、血栓症のリスクファクターとなることが最近注目されており、妊娠中、葉酸を経口摂取するという簡単なことでリスクを軽減できるといわれている。抗リン脂質抗体などが検出された不育症症例では血漿中の総ホモシステインを測定するべきかもしれない。

2.カリクレイン-キニン系と妊娠
不育症の中でも、トロンボモジュリン/プロテインC/プロテインS/第5因子系の破綻を特徴とする妊娠中、後期の子宮内胎児死亡については今回のテーマと異なるので、本稿では割愛させていただき、妊娠初期の流産と関係の深いカリクレイン-キニン系についてもう少し詳しく解説する。
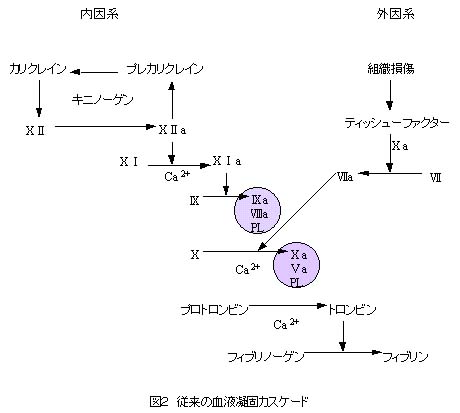
カリクレイン-キニン系は、第12因子、プレカリクレイン、キニノーゲンの3つの血漿蛋白より成り立っている(図1)。これらの蛋白はまた、plasma contact systemを構成する蛋白でもある(図2)。すなわち、これらの蛋白が陰性荷電の表面に集合することにより、内因系血液凝固カスケードが開始されるわけである。これらの蛋白が欠損すると、試験管内では血液は凝固せず、aPTTは延長する。しかしながら、生体内では出血傾向は見られず、逆に血栓症の危険因子となることが知られている。つまり、内因系血液凝固カスケード(contact factor pathway)は試験管の中では存在しても、生体内ではごく一部の例外を除いては存在しないことが最近になってわかってきたのである。
そもそも内因系の血液凝固というのは、血液がガラスの表面に接触することにより発見され、1958年にMargolisらによって報告された。その後、kaolin, ellagic, acid, dextran sulfateなどもcontact activationを引き起こすことが報告された。しかしながら、これらの物質は生体内には存在しないわけで、生体内でcontact activationを引き起こしている陰性荷電の表面というのは何であるか不明であった。コラーゲンが引き起こしていると長い間考えられてきたが、最近になって否定された。また、破綻した血管内皮細胞の表面に露出した基底膜がそうであろうという説もあるが、未だ証明されていない。唯一生体内で内因系血液凝固を引き起こすことが証明されているものはエンドトキシンである。しかしながら、これはseptic shockにおける内因系血液凝固しか説明できない。結局、結論としては生体内にはcontact activationを引き起こすような生理的陰性荷電の表面は存在せず、実際はcontact activationを引き起こすために陰性荷電の表面は必要ないということが明らかになってきた。
したがって、リン脂質という陰性荷電の物質を加えることにより、試験管内で内因系血液凝固を引き起こして凝固時間を測定する検査であるaPTTと、生体内で起きている反応は異なるわけである。たとえば、第12因子(Hageman factor)の先天性欠損症患者であるJohn Hagemanや、キニノーゲンの先天性欠損症患者であるMayme Williams(Williams trait)は両者とも出血傾向はなく、反対の肺塞栓症で死亡したのは有名な話である。また、ループスアンチコアグラントは試験管内ではaPTTを延長させるが、生体内では血栓症を引き起こすということも、内因系血液凝固系が生体内ではそのまま通用しないことを証明している。
カリクレイン-キニン系は胎児、胎盤の血管に存在していることが最近明らかになってきている。胎盤の大きな血管や臍帯ではなく、絨毛の毛細血管内皮細胞にキニノーゲンやプレカリクレイン、カリクレインが存在することが報告されており、キニンが胎盤の毛細血管に限局して産出されていることが示唆されている。キニンは抗凝固、線溶促進作用だけでなく、血流を増加させるなどの生物学的活性を持ったペプチドであり、胎盤内で放出され、胎盤の血流や代謝産物の経胎盤輸送などを調節する重要な役割を担っている可能性が指摘されている。カリクレイン-キニン系は全身の血液凝固、線溶系のみならず、特に生殖に非常に重要な位置を占めていると考えられる。
最近、カリクレイン-キニン系の蛋白の欠乏と反復流産との関係が報告されている。また、カリクレイン-キニン系蛋白に対する自己抗体と反復流産との関係も報告されている。カリクレイン-キニン系は、妊娠維持に重要な役割を果たしているので、その破綻は流産に直結するのかもしれない。
3.キニノーゲンに対する自己抗体
近年、抗リン脂質抗体と不育症との関係が注目を浴びている。抗リン脂質抗体とは、リン脂質に関する自己抗体であり、具体的には電気的陰性のリン脂質(カルジオリピン、フォスファチジルセリン、フォスファチジルグリセロール、フォスファチジルイノシトール、フォスファチジル酸)や、電気的中性の(フォスファチジルエタノールアミン、フォスファチジルコリン)に対する抗体である。
歴史的には、抗リン脂質抗体は梅毒血清反応陽性として検出されてきた。梅毒血清反応では、抗原としてカルジオリピンが使用されており、したがって陽性とはカルジオリピンに対する抗体の存在を示している。梅毒ではないのに抗カルジオリピン抗体をもつ患者の場合、梅毒血清反応の生物学的擬陽性として抗リン脂質抗体が検出されたわけである。
抗リン脂質抗体と一言で言っても、その実態は単純ではない。従来は名前通りリン脂質を認識する抗体であると思われてきたが、最近、病原性のある抗体の多くは実はリン脂質そのものを認識する抗体ではなく、リン脂質に結合する血漿蛋白に対する抗体であることがわかってきた。一番最初に発見された抗原はβ2-glycoprotein I (β2GPI)であり、当初はコファクターと称されたが、その後は事実上の抗カルジオリピン抗体の目標抗原ということでコンセンサスが得られている。次いで、プロトロンビンが報告された。これらは、カルジオリピンやフォスファチジルセリンなど、電気的陰性のリン脂質に対する抗体の対応抗原である。その後我々は、中性のリン脂質であるフォスファチジルエタノールアミンに対する抗体も同様にリン脂質結合蛋白を認識することを発見し、それがキニノーゲンであることを同定した。
抗カルジオリピン抗体やループスアンチコアグラントに特徴的なのは、妊娠中期以降の子宮内胎児死亡である。しかしながら、臨床で一番多く見られるのは妊娠初期流産を繰り返す不育症であり、そのような患者に対して抗カルジオリピン抗体やループスアンチコアグラントを検査しても陽性に出ることは期待するほど多くない。一方で、反復初期流産患者にもっとも多く見られる抗リン脂質抗体は抗PE抗体である。このことは我々が一昨年発表し、昨年になってフランスのGrisらによって同様の結果が報告された。さらに、不育症患者の持つ抗PE抗体の多くはキニノーゲンを認識することが明らかになった。現在、抗PE抗体がキニノーゲンのどの部位を認識しているのか、合成ペプチドを用いて検討しているが、キニノーゲンの細胞結合部位と、システインプロテアーゼ抑制部位を認識することが示唆されており、カリクレイン-キニン系を介した病原性を強く疑っている。
さらにさらに我々は、IVF-ETを3回以上施行しても妊娠に至らない原因不明不妊症に対して自己抗体を検討したところ、不妊症も妊娠初期反復流産症例と同様、高頻度に自己抗体が見出された。自己抗体の陽性頻度を原因不明不妊症と不育症で比較すると、抗核抗体(30.9%vs22.3%)、抗カルジオリピン抗体IgG(MBLのキット)(4.9%vs5.0%)、抗カルジオリピン-β2GPI抗体IgG(ヤマサのキット)(9.8%vs0.7%)、抗PE抗体IgG(16.4%vs15.1%)であった。両群とも自己抗体が高頻度に見られ、抗核抗体や抗カルジオリピン-β2GPI抗体抗体などを見ると、原因不明不妊症の方が免疫のバランスが崩れているような印象がある。抗PE抗体に関しては、両群とも同程度に見られ、正常群(4.0%)と比較しても統計学的に有意に高かった。いずれにしても、着床障害によると思われる原因不明不妊症と、妊娠初期の不育症は免疫学的背景は類似していると思われる。そして、キニノーゲンを認識する抗PE抗体の存在は無視できず、今後の研究が待たれる。
4.第12因子に対する自己抗体
近年、フランスのグループ(The Nimes Obstetricians and Haematologists : NOHA)が500人の原因不明妊娠初期反復流産患者に対して、血液凝固異常の有無について大規模な調査を行い、興味深い結果を発表している(NOHA study)。これによると、妊娠初期流産を繰り返すタイプの不育症では線溶系の低下が多く見られ(約40%)、その内容はplasminogen activator inhibitor 1(PAI)活性亢進であった。具体的には、第12因子欠乏症(9.4%)と抗リン脂質抗体(7.4%)が2大危険因子として報告されており、我々の不育症外来でも同様の結果が得られている。さらにその後、抗リン脂質抗体の内訳に関する検討が同じグループにより行われ、我々の不育症外来と同様、抗PE抗体がもっとも高頻度に見られたと報告されている。
さて、抗PE抗体、すなわちキニノーゲンを認識する抗体と並んで、第12因子欠乏症が高頻度に見られたことは非常に興味深い。なぜならば、キニノーゲンも第12因子も同じカリクレイン-キニン系、またはplasma contact systemの蛋白であるからである。
第12因子欠乏症が反復血栓症の患者に多いということは、以前より知られていた。反復動脈血栓または心筋梗塞患者の20%、反復静脈血栓疾患者の8%に第12因子欠乏症が存在すると報告されている。第12因子欠乏症における血栓形成の原因として、ブラジキニン産生が減少することにより血管内皮細胞からのtissue plasminogen activator(tPA)の分泌が減少するためではないかと推測されている。そして、10年ほど前より第12因子欠乏症と反復流産との関係が報告されるようになった。
我々の不育症外来においては、191人の不育症患者をスクリーニングしたところ、34人(17.8%)が第12因子活性60%未満であった。一方、正常対象群60人中第12因子活性60%未満であったのは1人であった。非常に興味深いことに、第12因子欠乏症患者34人中18人(52.9%)が何らかの自己抗体陽性(主に抗リン脂質抗体と抗核抗体)であり、13人(38.2%)は抗リン脂質抗体陽性であった。このことにより、第12因子欠乏には自己抗体が関与していることが強く示唆された。
最近になって、抗リン脂質抗体陽性患者に第12因子欠乏症が高頻度に存在するという報告がされた。また第12因子に対する自己抗体が存在することにより免疫複合体が形成され、第12因子欠乏症が起こるのではないかという仮説が提唱された。その後、抗リン脂質抗体陽性患者において、第12因子に対する自己抗体の存在が報告された。次いで我々も、第12因子欠乏不育症患者において第12因子に対する自己抗体の存在を報告した。第12因子は抗リン脂質抗体陽性患者の持つ自己抗体の認識する抗原リストに加えるべきかもしれない。
おわりに
生殖領域において、免疫と血液凝固は非常に重要な位置を占めている。現に、不育症の治療としては抗血小板療法である低用量アスピリン療法や、抗凝固療法であるヘパリン療法が取り入れられ、非常に効果を挙げている。また、原因不明不妊症についても同様の治療法が盛んに試みられつつある。しかしながら、このような凝固系に対するちりょうが広く行われるようになったにもかかわらず、生殖における血液凝固的アプローチはほとんどされていない。本稿では免疫学のみならず、血液凝固学という新しい角度から生殖における最近の新しい知見について解説した。